中國國家藥監(jiān)局藥品審評中心(CDE)網(wǎng)站最新數(shù)據(jù)顯示�,神州細胞已在中國提交了甲型血友病治療藥物重組人凝血因子VIII(SCT800)的上市申請。這不僅是神州細胞首個申報上市的產(chǎn)品�,也是首個申報上市的國產(chǎn)重組人凝血因子VIII。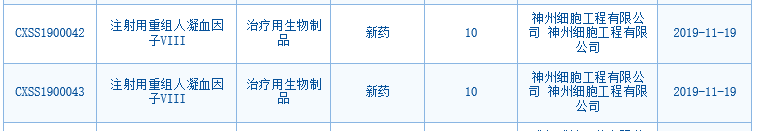
甲型血友病又稱A型血友病����,是一種遺傳的終生性疾病,大部分患者從出生體內(nèi)就缺少凝血因子Ⅷ���,輕微地觸碰就會出血�����,重癥患者沒有明顯外傷也可發(fā)生“自發(fā)性”出血�����。目前在我國����,血友病標準治療率低����,長期預后差而導致血友病兒童超過90%已出現(xiàn)不同程度的關(guān)節(jié)病變。SCT800為神州細胞自2008年開始自主研發(fā)的重組人凝血因子VIII蛋白����,擬用于治療甲型血友病。目前��,神州細胞已經(jīng)在成人及青少年甲型血友病中完成了SCT800的3期臨床研究,同時正在進行SCT800對兒童�、成人及青少年患者的預防治療3期研究。神州細胞是一家領(lǐng)先的創(chuàng)新型生物制藥研發(fā)公司����,專注于惡性腫瘤、自身免疫性疾病�����、感染性疾病和遺傳病等多個疾病治療和預防領(lǐng)域的生物藥產(chǎn)品研發(fā)和產(chǎn)業(yè)化����。今年9月16日,神州細胞剛向上海證券交易所提交了科創(chuàng)板IPO申請����。根據(jù)神州細胞的招股書,截至2019年7月31日����,該公司的產(chǎn)品管線包括21個創(chuàng)新藥和2個生物類似藥,其中8個產(chǎn)品獲準進入臨床研究階段����,6個品種完成藥性評價進入臨床前研究階段�����,9個品種完成候選藥物開發(fā)進入性評價階段。除了重組人凝血因子VIII SCT800外��,神州細胞的其它研究進展較快的產(chǎn)品包括SCT200�����、SCT-I10A�、SCT400等多款產(chǎn)品。SCT400是一款CD20單抗��,其針對非霍奇金淋巴瘤的3期臨床研究已經(jīng)完成�。SCT200產(chǎn)品為神州細胞自主研制的全人源EGFR單抗(IgG1亞型),其正在結(jié)直腸癌����、頭頸鱗癌、三陰乳腺癌等多種實體瘤中開展1期和2期臨床研究��。SCT-I10A為神州細胞研發(fā)的擬用于治療多種實體瘤的重組人源化抗PD-1 IgG4型單克隆抗體��,神州細胞已在實體瘤或淋巴瘤�、頭頸鱗癌中開展了三項關(guān)于SCT-I10A單藥或聯(lián)合療法的臨床研究�。


