近日�,BioSpace回顧了2019年10大新聞事件�,本文對此進(jìn)行編譯�����,以饗讀者。在過去的幾年里��,隨著多家公司接連宣告阿爾茲海默癥藥物的研發(fā)失敗,Biogen的aducanumab成為了最后的希望�����。然而,2019年3月,Biogen及其合作伙伴日本生物制藥公司Eisai(衛(wèi)材)宣布:將停止針對aducanumab治療阿爾茨海默氏癥輕度認(rèn)知障礙患者的兩項(xiàng)全球III期臨床試驗(yàn)ENGAGE和EMERGE�����,以及EVOLVEII期試驗(yàn)和PRIME Ib期長期試驗(yàn)��。其原因在于獨(dú)立數(shù)據(jù)監(jiān)測委員在對這些試驗(yàn)進(jìn)行無效性分析(futility analysis)后表示�,很難達(dá)到其主要終點(diǎn)。10月22日,這兩家公司卻再次宣布�����,EMERGE III期試驗(yàn)中aducanumab高劑量組達(dá)到其主要終點(diǎn)���,且高劑量組部分患者在接受藥物治療后�,在包括記憶力����、方向感和語言等在內(nèi)的認(rèn)知和功能指標(biāo)上有了明顯改善�����,并在生活活動(dòng)方面也表現(xiàn)明顯益處�����。該公司在與美國FDA進(jìn)行進(jìn)一步地討論后表示�,計(jì)劃將在2020年初提交生物制品許可上市申請,并將繼續(xù)與包括歐洲和日本在內(nèi)的國際市場監(jiān)管機(jī)構(gòu)進(jìn)行協(xié)商�����。12月5日,Biogen公司在美國圣地亞哥舉行的第12屆阿爾茲海默癥臨床試驗(yàn)(CTAD)會(huì)議上���,公開了aducanumab試驗(yàn)的全部數(shù)據(jù)。學(xué)界和投資界并沒有被這一消息沖昏頭腦,大多數(shù)人仍保持審慎態(tài)度。他們認(rèn)為盡管出現(xiàn)了一些讓人令人激動(dòng)的積極數(shù)據(jù),但兩項(xiàng)試驗(yàn)中仍存在令人擔(dān)憂的安全信號和混合結(jié)果�����,可能影響FDA是否批準(zhǔn)其上市申請��。aducanumab為治療阿爾茲海默癥提供了新的希望�����,但這一新藥的“過山車式經(jīng)歷”仍在繼續(xù)……今年6月��,默沙東首席商務(wù)官Frank Clyburn在5年來首個(gè)投資者日會(huì)議上表示����,在不久的未來���,Keytruda(帕博利珠單抗)將成為一種基礎(chǔ)性的癌癥治療方法。“目前我們的臨床試驗(yàn)涉及到了25種不同類型的癌癥……而Keytruda正在改變當(dāng)今患者的治療方式��。”盡管彼時(shí)許多分析師對該公司過度依賴該產(chǎn)品而感到擔(dān)憂�,但隨著Keytruda適應(yīng)癥的不斷獲批�,Clyburn的這些預(yù)言被證明不是為了哄抬股價(jià)而夸下的?���?凇?/span>有分析家認(rèn)為�����,Keytruda即將取代Humira(2023年失去美國市場專利保護(hù))在2025年之后成為世界上銷量最大的藥物�����。并且���,Keytruda 自2014年以來已經(jīng)獲得了20多項(xiàng)適應(yīng)癥批準(zhǔn),隨著2020年的到來����,Keytruda也可能會(huì)獲得更多的批準(zhǔn),有望在未來獲得更多收入���。Keytruda在中美兩國的適應(yīng)癥獲批情況

并購是日新月異的生物技術(shù)行業(yè)不變的主題����。2019年�����,隨著一些并購案的發(fā)生����,行業(yè)格局也發(fā)生了幾次大規(guī)模的變化。
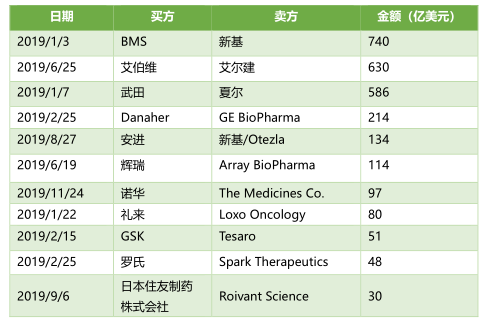
首先不得不提及的是����,1月,BMS宣布將以740億美元收購Celgene����。這兩家制藥巨頭的“強(qiáng)強(qiáng)聯(lián)手”創(chuàng)造了腫瘤學(xué)、血液學(xué)、免疫學(xué)和心血管疾病領(lǐng)域的巨擘�����。自合并以來���,BMS先后獲批了一些藥物上市,其中包括由Celgene開發(fā)�,已被FDA批準(zhǔn)用于治療患有β地中海貧血癥的成年患者的Reblozyl(luspatercept-AAMT)。6月,AbbVie宣布斥資630億美元收購肉毒桿菌生產(chǎn)商艾爾建(Allergan)�����。達(dá)成最終交易協(xié)議時(shí)�,艾伯維方面表示���,艾爾建現(xiàn)有管線和產(chǎn)品的增加將立即為公司的產(chǎn)品布局帶來更大的效益規(guī)模�����,以減少目前對重磅藥物Humira的過度依賴。自合并后��,該公司將在免疫學(xué)��、血液腫瘤學(xué)、醫(yī)學(xué)美學(xué)��、神經(jīng)科學(xué)�����、婦女健康�、眼睛護(hù)理和病毒學(xué)方面擁有一些產(chǎn)品的特許經(jīng)營權(quán)���。盡管以上兩個(gè)事件是2019年最大手筆的并購案����,但還有一些并購案���,也在影響著整個(gè)生物技術(shù)領(lǐng)域的風(fēng)云變化��。例如:Mylan與輝瑞普強(qiáng)(Upjohn)的合并��。這一新公司將通過整合原兩家公司高度互補(bǔ)的業(yè)務(wù)�,進(jìn)一步拓展市場�。全新的產(chǎn)品管線中將出現(xiàn)許多知名品牌�,如預(yù)計(jì)Epi-Pen�����,Viagra,Lipitor��,Celebrex等��,預(yù)計(jì)將在2020年收入達(dá)到200億美元����。2019年1月, BMS豪擲740億美元收購Celgene成為本年度最大手筆的交易���。9月��,日本住友制藥株式會(huì)社(Sumitomo Dainippon Pharma)與Roivant Science公司所達(dá)成的一項(xiàng)高達(dá)30億美元的交易也頗受圈內(nèi)人的關(guān)注����。日本住友制藥以30億美元的預(yù)付款買下Roivant Sciences公司旗下5家“Vant系”子公司,同時(shí)�����,住友制藥還將獲得Roivant公司10% 的股份,以及收購另外6家企業(yè)的選擇權(quán)���。根據(jù)交易細(xì)節(jié)披露,日本住友制藥將新建一家公司�����,將已收購的Myovant Sciences (女性健康和前列腺癌)��、Urovant Sciences (泌尿系統(tǒng)疾病)��、Enzyvant Therapeutics (兒童罕見疾病)�、Altavant Sciences (呼吸系統(tǒng)罕見疾病) �,以及Spirovant Sciences(囊性纖維化的基因療法)這5家公司納入到統(tǒng)一管理中�����。同時(shí)��,這家新公司將由前基因泰克高管���、Roivant的執(zhí)行主席Myrtle Potter暫為管理運(yùn)營��。此外�����,除了30億美元的預(yù)付款,日本住友制藥還將需要為Myovant Sciences公司提供3.5億的貸款�,用于治療子宮肌瘤臨床III候選藥物relugolix的后續(xù)研究及上市申請;以及為Urovant Sciences公司提供2億美元的貸款���,用于膀胱過度活動(dòng)癥藥物vibegron的后續(xù)開發(fā)。未來,如果日本住友制藥行使繼續(xù)收購其他6家公司的選擇權(quán)���,還有望在2020年到2022年間獲得超過25種在研藥物的開發(fā)工作��,以及Roivant專有技術(shù)平臺(tái)DrugOme和Digital Innovation的使用權(quán)����。2018年11月�,南方科技大學(xué)原副教授賀建奎聲稱�,其利用CRISPR-Cas9基因編輯技術(shù)改變了7對夫婦的胚胎DNA��,并創(chuàng)造出全球首例免疫艾滋病基因編輯雙胞胎���,引發(fā)基因編輯倫理丑聞。對此�����,2019年3月13日�,包括張峰、Emmanuelle Charpentier在內(nèi)的7個(gè)國家的18位領(lǐng)先研究人員和生物倫理學(xué)家在《Nature》雜志上發(fā)表文章《Adopt a moratorium on heritable genome editing》����,呼吁在全球范圍內(nèi)暫停人類生殖系基因編輯的所有臨床用途���。同時(shí)他們還表示:“‘全球暫?����!⒉灰馕吨谰媒?����。相反�����,我們呼吁建立一個(gè)國際框架��,在這個(gè)框架中���,各國在保留自己決定權(quán)的同時(shí)����,自愿承諾除非滿足某些條件�,否則不予批準(zhǔn)任何臨床生殖系的基因編輯試驗(yàn)�����。”2019年12月30日,據(jù)新華社報(bào)道,“基因編輯嬰兒”案在深圳市南山區(qū)人民法院一審公開宣判。賀建奎��、張仁禮���、覃金洲等3名被告人因共同非法實(shí)施以生殖為目的的人類胚胎基因編輯和生殖醫(yī)療活動(dòng)����,構(gòu)成非法行醫(yī)罪�,分別被依法追究刑事責(zé)任����。2019年11月11日,歐盟委員會(huì)(EC)批準(zhǔn)默沙東(Merck & Co)的埃博拉疫苗Ervebo(V920)上市,成為全球首款獲批上市的埃博拉疫苗�。12月19日��, FDA同樣宣布批準(zhǔn)Ervebo上市�����,成為了FDA批準(zhǔn)的首款用于18歲及以上人群的主動(dòng)免疫,以預(yù)防扎伊爾型埃博拉病毒(Ebola Zaire)引起的埃博拉病毒?�。‥VD)。2018年8月以來���,剛果民主共和國爆發(fā)了該地區(qū)有史以來第二大的埃博拉疫情���,在此期間約有2000多人死于該疾病�。在該疫苗獲批之前�,默沙東便為該地區(qū)提供了該疫苗的大量研究制劑�,并完成了超25萬人次的疫苗接種。此外�����,強(qiáng)生旗下的楊森制藥公司也正在開發(fā)另外一種埃博拉疫苗����,該疫苗目前已給予剛果東部戈馬市中的5萬人使用���。與默克1針疫苗方案相比,強(qiáng)生疫苗需要在首針注射8周后�����,進(jìn)行再次注射。該疫苗目前已向歐洲藥品管理局(EMA)提交了2份營銷授權(quán)申請(MAA)��。曾經(jīng)以阿片類止痛藥OxyContin(奧施康定)聞名的普渡制藥(Purdue Pharma),因深陷數(shù)千起與阿片類藥物成癮危機(jī)有關(guān)的訴訟�,并無力支付100-120億美元的法律和解費(fèi)用����,從而申請破產(chǎn)����。當(dāng)?shù)卣_指責(zé)了該公司因過度積極推銷處方止痛藥OxyContin��,并在該產(chǎn)品的過量風(fēng)險(xiǎn)提示上誤導(dǎo)醫(yī)生和患者�����,進(jìn)而助長了美國阿片類藥物危機(jī)�����。截止目前美國社會(huì)已有數(shù)千人因阿片類藥物過量服用而死亡。在普渡制藥申請破產(chǎn)的同時(shí),其資產(chǎn)將被重組為一家新的公司��,且新公司的董事會(huì)將由債權(quán)人選出����,由破產(chǎn)法院批準(zhǔn)��。根據(jù)聲明�����,這家新公司將以幾乎0成本的方式來生產(chǎn)治療阿片成癮的相關(guān)藥物�,例如納美芬和納洛酮。因出現(xiàn)問題而召回藥物的情況在歷史上并不少見���。而2019年的較多藥物召回事件似乎都與制藥工藝過程中存在致癌物質(zhì)有關(guān)���。自2018年華海藥業(yè)的纈沙坦事件后���,F(xiàn)DA一直在針對高血壓和心衰藥品(稱為ARB)中的NDMA(N-亞硝基二甲胺)和其他亞硝酸胺類雜質(zhì)進(jìn)行調(diào)查�,并建議召回了許多制造商的多種類型的血管緊張素II受體阻滯劑產(chǎn)品����。 直到2019年9月13日,F(xiàn)DA、EMA發(fā)文表示:不僅僅是降壓藥物受到污染����,相關(guān)雷尼替丁藥品(一種抑制胃酸分泌的藥物���,可用于治療消化性潰瘍等疾病的經(jīng)典治療藥物��。)中也含有低水平亞硝胺雜質(zhì)NDMA�。于是���,雷尼替丁的召回風(fēng)波開啟了��。在美國FDA發(fā)出安全警告后�,陸續(xù)有多家跨國藥企自愿召回產(chǎn)品并遭受沖擊����。先是諾華宣布暫停山德士公司在市場銷售所有含有雷尼替丁的藥物��,包括在美銷售的膠囊藥物�����,涉及26個(gè)國家����。GSK也宣布,暫停向包括印度在內(nèi)的全球市場供應(yīng)雷尼替丁藥物,并啟動(dòng)召回���,以作為預(yù)防措施��,以待全球正在進(jìn)行的測試和調(diào)查得出結(jié)果�����。其他藥企諸如印度瑞迪博士藥廠���、山德士公司、加拿大Apotex制藥公司、印度Strides制藥陸續(xù)表示���,暫停其雷尼替丁藥物在全球或美國的供應(yīng)或銷售���、自愿召回美國境內(nèi)相關(guān)批次���、某些規(guī)格�����、相關(guān)供應(yīng)原料生產(chǎn)的雷尼替丁�����。2018年11月,雅培實(shí)驗(yàn)室的研究人員發(fā)現(xiàn)了一種新的HIV毒株����,這也是近20年來首次發(fā)現(xiàn)的一種新的HIV-1亞型,它的起源可以追溯至非洲的剛果民主共和國�����。這一新菌株的發(fā)現(xiàn)�����,意味著研究人員或可開發(fā)出針對艾滋病的潛在新療法�����。自艾滋病在全球流行以來,已有超過7500萬人曾被HIV病毒感染。這一曾經(jīng)近似“死刑”宣判的疾病����,隨著新藥物和新療法的發(fā)展���,已有超3790萬人得以控制病情并繼續(xù)存活下來����。除此之外����,今年還有很多針對HIV病毒的新療法獲批���。例如�,默沙東Pifeltro和Delstrigo被批準(zhǔn)聯(lián)合用藥治療HIV-1患者����;吉利德公司的Descovy被批準(zhǔn)用于HIV暴露前預(yù)防。此外����,還有許多新的療法尚在研發(fā)之中���,例如���,GSK旗下ViiV的Cabotegravir和楊森的rilpivirine聯(lián)合用藥�;北京大學(xué)鄧宏魁教授及其團(tuán)隊(duì)發(fā)明的使用CRISPR技術(shù)和調(diào)節(jié)蛋白BRD4的骨髓移植�����;長非編碼RNA的遺傳修飾等等。隨著2019年這些潛在療法的發(fā)現(xiàn),將為未來HIV患者的治療帶來更多的選擇��。近年來����,3D打印技術(shù)逐漸成熟。2019年4月�����,特拉維夫大學(xué)的研究人員使用患者自己的細(xì)胞及各種生物材料成功地打印了第一顆含有血管的3D仿生心臟��。領(lǐng)導(dǎo)該研究的Tal Dvir教授表示:“這顆心臟是由患者的細(xì)胞和特定的生物材料制成的��。在我們的工藝過程中����,這些材料可作為生物墨水(由糖和蛋白質(zhì)制成的物質(zhì)),用于復(fù)雜組織模型的3D打印����。過去人們設(shè)法對心臟結(jié)構(gòu)進(jìn)行3D打印,然而無法打印出相應(yīng)的細(xì)胞或血管��。我們的研究結(jié)果證明了未來設(shè)計(jì)出可替代的個(gè)性化組織和器官的潛力。”這也將意味著��,人類已在3D打印器官方面取得重大突破,其發(fā)展方向不僅是為了科學(xué)研究����,也可能是為了器官替代。



